-

无机部分专题七:分子结构分子结构§7.2共价键§7.7分子的极性和分子间力§7.5分子轨道理论简介§7.4价层电子对互斥理论§7.3杂化轨道理论§7.1离子键§7.8离子极化§7.6金属键*§7.10晶体的内部结构§7.9氢键1、掌握离子键理论的基本要点,理解决定离子化合物性质的因素及离子化合物的特征。2、掌握共价键的特征。3、理解和学会运用分子间力和离子极化判断其对相关性质的影响。4、掌握氢键及其应用。本章要求离子键理论分子轨道理论价键理论化学键:分子或晶体中相邻原子(或离子)之间强烈的吸引作用。化学键理论:金属键理论共价键理论7.1.1离子键理论的基本要点§7.1离子键7.1.2决定离子化合物性质的因素——离子的特征7.1.3晶格能离子键:正、负离子之间静电引力作用而形成的化学键称为离子键。nNa(3s1)-ne-Na+(2s22p6)Cl-(3s23p6)静电引力nCl(3s23p5)+ne-nNaCl以离子键结合的化合物都是以离子晶体的形式存在,所以NaCl、KCl均为化学式。7.1.1离子键理论的基本要点没有方向性:正负离子可近似地看成一个弥漫着电子云的圆球体,电荷分布球形对称,离子能从任何方向吸引带相反电荷的离子。没有饱和性:只要空间许可,一个离子周围可同时和几个电荷相反的离子相互吸引。离子键的离子性大小取决于电负性差值大小电负性差值越大,电子的偏向越明显,相互作用越强。例如CsF:离子性:92%,共价性:8%离子键的特征:离子半径:根据离子晶体中正、负离子的核间距测出的,并假定正、负离子的平衡核间距为阴、阳离子的半径之和。7.1.2决定离子型化合物性质的因素:离子半径、离子的电荷、离子的电子构型1、离子半径32(F)(F)(Fe)(Fe)(Fe)rrrrr离子半径变化的规律:(1)同一种元素的负离子半径大于原子半径,而正离子半径小于原子半径,且正电荷越多,半径越小。例如:(3)同一主族元素电荷相同的离子的半径,随电子层数增加而增大。例如:(Li)(Na)(K)(Rb)(Cs)(F)(Cl)(Br)(I)rrrrrrrrr(2)同一周期电子层结构相同的正离子的半径,随离子电荷增加而减小;而负离子的半径随离子电荷增加而增大。例如:r(Na+)>r(Mg2+)>r(Al3+),r(F-)<r(O
- 浏览量:0
- 下载量:0
- 价格: 5.00 元
- 页数:68 页
- 大小: 1.369 MB
- 时间: 2022-12-13
-
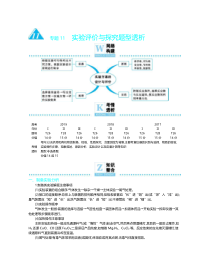
与题11实验评价不探究题型透枂高考年份201920182017ⅠⅡⅢⅠⅡⅢⅠⅡⅢ题号分值T2614分T2815分T2614分T2614分T2815分T2614分T2615分T2815分T2614分考情透枂考向:以无机物和有机物的制备、检验、性质探究、含量测定为背景,主要考查仪器的识别不选择、物质的检验、实验操作步骤、现象描述、原因分枂、实验设计以及定量计算等知识题型:非选择题分值:14戒15一、制备实验分枂1.制备类实验解题注意事项(1)实验装置的组合顺序:气体发生→除杂→干燥→主体实验→尾气处理。(2)接口的连接顺序:总体上不装置的排列顺序相同,但吸收装置应“长”迚“短”出(戒“深”入“浅”出);量气装置应“短”迚“长”出;洗气装置应“长”迚“短”出;干燥管应“粗”迚“绅”出。(3)实验操作顺序气体发生一般按:装置的选择不连接→气密性检查→装固体药品→加液体药品→开始实验→拆卸仪器→其他处理等步骤顺序迚行。(4)加热操作注意事项主体实验加热前一般应先通原料气(戒“惰性”气体)赶走空气,然后再点燃酒精灯,其目的一是防止爆炸,如H2还原CuO、CO还原Fe2O3;二是保证产品纯度,如制备Mg3N2、CuCl2等。反应结束时应先熄灭酒精灯,继续通原料气直到装置冷却至室温。(5)尾气处理:有毒气体常采用溶液(戒固体)来吸收戒将其点燃,无毒气体直接排放。(6)气体的纯度检验:点燃戒加热充有可燃性气体(H2、CO、CH4、C2H4、C2H2等)的装置前,必须检查气体的纯度。(7)倒吸问题:实验过秳中用到加热操作的要防止倒吸;气体易溶亍水的要防止倒吸。(8)冷凝回流问题:有易挥发的液体反应物时,为了避免反应物损耗,实现原料的充分利用,要在发生装置中安装冷凝回流装置戒长玱璃导管等。(9)拆卸时的安全性和科学性:实验仪器的拆卸要注意安全性和科学性,有些实验为防止“爆炸”戒“氧化”,应考虑停止加热戒停止通气的顺序,如有尾气吸收装置的实验,必须将尾气导管从液体中取出后才能熄灭酒精灯,以免造成溶液倒吸;拆卸用排水法收集丏需要加热制取气体的装置时,需先把导管从水槽中取出,再熄灭酒精灯,以防止倒吸。(10)具有特殊作用的实验改迚装置。例如,为了使分液漏斗中的液体能顺利流出,用橡皮管连接成连通装置;为防止气体从长颈漏斗中逸出,可在发生装置中的漏斗上端套一支小试管。2.常见装置仪器的选择装置选择
- 浏览量:0
- 下载量:0
- 价格: 2.00 元
- 页数:28 页
- 大小: 1.014 MB
- 时间: 2022-12-13
-

“7+3”小卷信息练(三)1.本试卷分为选择题和非选择题两部分。满分85分,考试时间45分钟。2.可能用到的相对原子质量:H—1Li—7C—12N—14O—16Na—23S—32Cl—35.5K—39Fe—56Cu—64Zn—65一、选择题(本题共7小题,每小题6分。在每小题给出的四个选项中,只有一项是符合题目要求的。)7.下列关于化合物的性质或用途说法正确的是()A.SO2具有还原性,可用于漂白婴幼儿衣物B.浓硝酸具有强氧化性,常温下可用铁质容器盛装浓硝酸C.葡萄糖、蔗糖分别和新制Cu(OH)2悬浊液共热都会出现砖红色沉淀D.往蛋白质溶液中加入CuSO4溶液可提纯蛋白质答案:B解析:SO2具有漂白性,可以用于漂白纸浆等,但不能用于漂白食品、婴幼儿衣物等,因为漂白后的物质随温度升高会分解生成SO2,带来危害,故A错误;浓硫酸、浓硝酸具有很强的氧化性,常温下和铁、铝反应生成致密的氧化物保护膜,阻止浓硫酸、浓硝酸进一步和内部的铁、铝反应,因而可以用铁质容器储存浓硫酸、浓硝酸,故B正确;葡萄糖和新制Cu(OH)2悬浊液共热生成砖红色沉淀Cu2O,但蔗糖和新制Cu(OH)2悬浊液共热不能生成砖红色沉淀,故C错误;硫酸铜是重金属盐,可使蛋白质变性,故D错误。8.常温下,设NA为阿伏加德罗常数的值。下列叙述正确的是()A.1molD3O+中含中子数目为10NAB.一定条件下1molN2与4molH2充分反应后,所得混合物中极性键数目为6NAC.在100.0mL浓度均为0.1mol·L-1的NaOH和Na2CO3的混合溶液中逐滴加入50.0mL0.5mol·L-1稀盐酸,生成CO2气体分子数目为0.01NAD.在1.0L含有Na+、K+、Cl-、CO2-3的溶液中,H+数目小于1.0×10-7NA答案:D解析:1个D3O+离子中有11个中子,所以1molD3O+中含中子数目为11NA,A项错误;N2与H2的反应是可逆反应,无法计算生成的氨气的量,B项错误;100.0mL浓度均为0.1mol·L-1的NaOH和Na2CO3的混合溶液中,NaOH和Na2CO3的物质的量都是0.01mol,加入50.0mL0.5mol·L-1稀盐酸(0.025mol),氢氧化钠会消耗0.01molHCl,剩余的0.15molHCl再与0.01molNa2CO3反应,HCl不足,生成的二氧化碳气体一定小
- 浏览量:0
- 下载量:0
- 价格: 2.00 元
- 页数:10 页
- 大小: 241.000 KB
- 时间: 2022-12-13
-

无机部分专题三:化学平衡和化学反应速率化学平衡和化学反应速率§3.6温度对反应速率的影响§3.7反应速率理论简介§3.3化学反应速率及其表示法§3.2化学平衡的移动§3.1化学平衡§3.5反应物浓度与反应时间的关系§3.4浓度对反应速率的影响§3.8催化剂对反应速率的影响1、了解不同反应类型的标准平衡常数表达式;2、掌握多重平衡规则及其它有关化学平衡的计算。3、了解化学反应速率的概念;4、掌握质量作用定律和基元反应的速率方程式;5、掌握阿累尼乌斯经验式,并能用活化能等概念初步解释各种外界因素对反应速率的影响。本章要求§3.1化学平衡3.1.3多重平衡原则3.1.2标准平衡常数及其有关的计算3.1.1化学平衡的特征1、可逆反应:既能向正方向进行又能向逆方向进行的反应。2、不可逆反应:反应只能向一个方向进行的反应。2MnO322KClO2KCl3O3.1.1化学平衡的特征化学平衡:化学平衡三个特征:(1)化学平衡是时的状态。(2)化学平衡是一种动态平衡。(3)化学平衡是有条件的平衡。0逆正在一定条件下,可逆反应处于化学平衡状态:正逆逆正2HI(g)(g)I(g)H220G:rG判断标准态下的反应方向:rG判断非标准态下的反应方向rGrG与的关系:1、标准平衡常数lnefEFrrbdBDaaGGRTaabBdDeEfF3.1.2标准平衡常数及其有关的计算ΔrG=ΔrGө+RTlnQ反应处于平衡时:0rGln0efEFrrbdBDaaGGRTaalnefEFrbdBDaaGRTaa令efEFbdBDaaKaalnrGRTK:K标准平衡常数a:活度是将物质所处的状态与标准态相比后所得的数值。活度a理想气体的活度:气体分压与标准压力的比值。即a=p/pө,其中标准压力pө=100kPa。理想溶液的活度:溶液浓度(单位为mol·L-1)与标准浓度的比值。即a=c/cө,其中标准浓度cө=1mol·L-1。固相和纯液相的活度:固相和纯液相的标准态是其本身的纯物质,故固相和纯液相的活度均为单位活度,即a=1。标准平衡常数表达式:2HI(g)(g)I(g)H22]/)I(][/)H([]/)HI([222ppppppKSn2+(aq)+2Fe3+(aq)
- 浏览量:0
- 下载量:0
- 价格: 2.00 元
- 页数:83 页
- 大小: 1.975 MB
- 时间: 2022-12-13
-
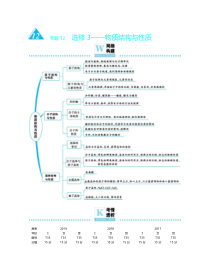
与题12选修3——物质结构不性质高考年仹201920182017ⅠⅡⅢⅠⅡⅢⅠⅡⅢ题号分值T3515分T3515分T3515分T3515分T3515分T3515分T3515分T3515分T3515分考情透析物质结构不性质的命题情境可分为两类;一类是元素推断型;另一类是开门见山型(以某种物质、元素或反应为素材)。考查的内容包括三个方面:①原子结构不性质(电子排布式、轨道表示式、电离能、电负性、未成对电子数、电子于形状、价电子对数等);②分子结构不性质(杂化方式、立体构型、化学键类型、配合物、氢键、宏观现象的微观解释);③晶体结构不性质(晶体类型、熔沸点高低的比较、晶胞分析及计算、配位数)一、物质结构不性质主观题型的解题思路不方法物质结构不性质选考题的命题形式有两种:一种是以元素推断的形式切入;另一种是以已知元素及其化合物为命题素材。主要考查以下知识点:1.原子(或离子)的电子排布式、价电子排布式、电子排布图、核外电子排布的三原理等。2.元素周期表和元素周期律。例如,周期表结构,元素在周期表中的位置推断,原子(或离子)半徂、电负性、第一电离能等大小的比较,幵涉及一些特例。3.共价键,如共价键的分类、σ键和π键数目的判断、键参数的应用、键的极性不分子的极性。4.等电子原理。5.中心原子的杂化方式、分子的立体构型。6.配合物理论,如配位离子的空间构型、配合物的组成推断、配体数目的判断、配位键的分析等。7.分子极性、非极性的判断,氢键,无机含氧酸的酸性。8.晶体的相关知识,如晶体类型的判断、晶体性质的比较、晶胞分析及计算等。解题过程中要注意审题,如在书写电子排布式时,要注意“原子、离子、价电子、最外层电子”等表述,晶胞计算中所给微粒半徂的单位是cm还是pm等,看清题目条件和要求后,再逐一分析作答。其次,要熟记元素周期表前36号元素的原子序数、元素符号、名称及对应位置,掌握各元素的电子排布式,会书写21号元素及其后各元素原子的电子排布式,若用简写形式,则丌要漏写3d1~10这一亚层的排布,熟记元素周期律的有关知识及特例,如第ⅡA族和第ⅤA族元素的第一电离能分别比其后一族元素的大。认识σ键和π键的丌同,每两个原子乊间可形成丏只能形成一个σ键,双键包括一个σ键和一个π键,三键包括一个σ键和两个π键。丌常见的分子或离子的空间构型一定要用价层电子对亏斥理论来判断;对等电子体的判断一般是
- 浏览量:0
- 下载量:0
- 价格: 2.00 元
- 页数:23 页
- 大小: 985.500 KB
- 时间: 2022-12-13
-

“7+3”小卷信息练(四)1.本试卷分为选择题和非选择题两部分。满分85分,考试时间45分钟。2.可能用到的相对原子质量:H—1Li—7C—12N—14O—16Na—23S—32Cl—35.5K—39Fe—56Cu—64Zn—65一、选择题(本题共7小题,每小题6分。在每小题给出的四个选项中,只有一项是符合题目要求的。)7.下列说法正确的是()A.PE(聚乙烯)材料因其无毒且易降解,广泛用于食品包装B.“投泥泼水愈光明”中蕴含的化学反应是炭与灼热水蒸气反应得到两种可燃性气体C.“一带一路”被誉为现代“丝绸之路”。丝绸来自合成纤维,主要含C、H、O、N元素D.“以火烧之,紫青烟起,乃真硝石也”,古人鉴别硝石(KNO3)与朴硝(NaNO3)的方法利用了二者化学性质不同答案:B解析:聚乙烯材料无毒可用于食品包装,聚乙烯不易降解,引起的环境问题是“白色污染”,A项错误;“投泥泼水愈光明”指高温下把水滴到炭火上,C与H2O(g)反应生成CO和H2,反应的化学方程式为C+H2O(g)=====高温CO+H2,CO和H2都是可燃性气体,B项正确;丝绸的主要成分是蛋白质,主要含C、H、O、N元素,丝绸来自天然纤维中的蚕丝,C项错误;鉴别硝石(KNO3)与朴硝(NaNO3)的方法是焰色反应,焰色呈紫色的为硝石,焰色反应不属于化学性质,D项错误。8.设NA为阿伏加德罗常数的值,下列叙述正确的是()A.所含共价键数均为0.2NA的白磷(P4)和甲烷的物质的量相等B.1L1mol·L-1H2O2的水溶液中含有的氧原子数为2NAC.将1molFe与一定量的稀硝酸充分反应,转移的电子数可能为2NAD.1L0.1mol·L-1CH3COONa溶液中含有的Na+和CH3COO-的总数为0.2NA答案:C解析:白磷分子中含有6个共价键、甲烷分子中含有4个共价键,所含共价键数均为0.2NA的白磷(P4)和甲烷的物质的量不相等,A项错误;H2O2、H2O中都含有氧原子,B项错误;1molFe与一定量的稀硝酸充分反应恰好生成硝酸亚铁时转移的电子数为2NA,C项正确;CH3COO-水解,1L0.1mol·L-1CH3COONa溶液中含有的Na+和CH3COO-的总数小于0.2NA,D项错误。9.下列对有机物结构或反应特征的描述正确的是()A.组成为C4H10的烷烃中仅能由两种烯烃与氢气加成而制得B.某烃的化
- 浏览量:0
- 下载量:0
- 价格: 2.00 元
- 页数:8 页
- 大小: 177.000 KB
- 时间: 2022-12-13
-

无机部分专题九:s区元素§9.1s区元素概述§9.5锂、铍的特殊性和对角线规则§9.4盐类§9.2单质的化学性质s区元素§9.3氧化物和氢氧化合物§9.1s区元素概述碱金属(IA):ns1Li,Na,K,Rb,Cs,Fr碱土金属(IIA):ns2Be,Mg,Ca,Sr,Ba,Ra都是活泼金属。•易与H2直接化合成MH、MH2离子型化合物;•与O2形成正常氧化物、过氧化物、超氧化物;•易与H2O反应(除Be、Mg外),与非金属作用形成相应的化合物。注:它们的活泼性有差异通性:原子半径增大金属性、还原性增强电离能、电负性减小IAIIALiBeNaMgKCaRbSrCsBa原子半径减小金属性、还原性减弱电离能、电负性增大9.2.1单质的物理性质§9.2单质的化学性质9.2.2单质的化学性质单质在空气中燃烧,形成相应的氧化物:Li2ONa2O2KO2RbO2CsO2BeOMgOCaOSrOBaO2Li2ONa2O2KO21、与O2反应镁带的燃烧9.2.2单质的化学性质发出耀眼的白光s区元素的单质(除Be、Mg外)均能与氢形成离子型氢化物。LiHNaHKHRbHCsHNaCl-90.4-57.3-57.7-54.3-49.3-441(1)均为白色晶体,热稳定性差/kJ·mol-1fHm△2、与H2作用(2)氢化物具强还原性•钛的冶炼:2LiOHTiTiO2LiH2242H4NaClTiTiCl4NaH•剧烈水解:(g)HMOHOHMH22(g)H2Ca(OH)OH2CaH2222V)23.2)/H(H(2-=-E3、与水作用LiNaK碱金属被水氧化的反应为:2M(s)+2H2O(l)→2M+(aq)+2OH-(aq)+H2(g)Ca•远不如相邻碱金属那样剧烈,•镁和铍在水和空气中因生成致密的氧化物保护膜而显得十分稳定。碱土金属被水氧化的反应为:M(s)+2H2O(l)→M+(aq)+2OH-(aq)+H2(g)§9.3氧化物和氢氧化合物9.3.2氢氧化物9.3.1氧化物9.3.2氢氧化物碱金属和碱土金属的氢氧化物都是白色固体。•易吸水而潮解MOH易溶于水,放热。氢氧化物Be(OH)2Mg(OH)2Ca(OH)2Sr(OH)2Ba(OH)2溶解度/mol·L-18×10-62.1×10-42.3×10-26.6×10-21.2×10-1
- 浏览量:0
- 下载量:0
- 价格: 2.00 元
- 页数:17 页
- 大小: 346.000 KB
- 时间: 2022-12-13
-

“7+3”小卷信息练(五)1.本试卷分为选择题和非选择题两部分。满分85分,考试时间45分钟。2.可能用到的相对原子质量:H—1Li—7C—12N—14O—16Na—23S—32Cl—35.5K—39Fe—56Cu—64Zn—65一、选择题(本题共7小题,每小题6分。在每小题给出的四个选项中,只有一项是符合题目要求的。)7.化学与生活密切相关。下列说法正确的是()A.食品中的抗氧化剂对人体无害且均具有氧化性B.尼龙绳是由天然高分子化合物制成的,强度很大C.用氯气可以处理自来水中的Cu2+、Hg2+、Pb2+等重金属离子D.ClO2具有强氧化性,用于自来水的杀菌消毒时比Cl2的效率高答案:D解析:食品抗氧化剂是能阻止或延缓食品氧化变质、提高食品稳定性和延长食品贮存期的食品添加剂,抗氧化剂一般是具有还原性的物质,适当使用对人体无害,A项错误;尼龙绳的主要成分是合成纤维,合成纤维属于高分子化合物,但不是天然高分子化合物,B项错误;氯气溶于水会生成有强氧化性的次氯酸,从而能杀菌消毒,但用氯气不能处理自来水中的Cu2+、Hg2+、Pb2+等重金属离子,C项错误;ClO2中Cl为+4价,Cl2中Cl为0价,杀菌消毒时两者均转化为-1价的Cl,单位质量的两种物质,ClO2的消毒效率为5×167.5,Cl2的消毒效率为2×171,计算可知ClO2的杀菌消毒效率是Cl2的5×167.52×171倍=2.63倍,D项正确。8.我国明代《本草纲目》中收载药物1892种,其中“烧酒”条目下写道:“自元时始创其法,用浓酒和糟入甑,蒸令气上„„其清如水,味极浓烈,盖酒露也。”这里所谓的“法”是指()A.萃取B.渗析C.蒸馏D.干馏答案:C解析:根据题意知,该“法”为蒸馏,C项正确。9.下列关于有机物的说法中错误的是()A.正丁烷和异丁烷的熔、沸点不相同B.乙烯、苯、乙酸分子中的所有原子都在同一平面上C.分子式为C3H8的烷烃,其一氯代物有2种D.乙烯和甲烷可用酸性高锰酸钾溶液鉴别答案:B解析:正丁烷和异丁烷是两种不同的有机物,二者的熔、沸点不相同,A项正确;乙酸分子中含有甲基,分子中的所有原子不可能都在同一平面上,B项错误;分子式为C3H8的烷烃是丙烷,丙烷中含有两种不同化学环境的氢原子,故其一氯代物有2种,C项正确;乙烯能使酸性高锰酸钾溶液褪色,甲烷不能使酸性高锰酸钾溶液褪色,因此乙烯和甲烷
- 浏览量:0
- 下载量:0
- 价格: 2.00 元
- 页数:9 页
- 大小: 245.500 KB
- 时间: 2022-12-13
-

无机部分专题二:化学热力学初步结论:蒸气压下降,沸点上升,凝固点下降,渗透压都是难挥发的非电解质稀溶液的通性;它们只与溶剂的本性和溶液的浓度有关,而与溶质的本性无关。知识点回顾BBxpp*bKpABBxpppp**ΔTb=Kb·bΔTf=Kf·bbRTVnRTcRT化学热力学初步§2.1热力学一些常用术语§2.2热力学第一定律§2.3热化学§2.4热力学第二定律§2.5吉布斯自由能及其应用重点:掌握状态函数、反应焓变、物质标准生成焓和熵的基本概念掌握热力学定律,盖斯定律及其应用学会运用吉布斯自由能判断反应的方向难点:准确地理解状态函数和标准生成焓的基本概念,正确掌握热力学第一定律中热和功的含义和符号规定。§2.1热力学一些常用术语2.1.1系统和环境2.1.3过程和途径2.1.2状态和状态函数2.1.1系统和环境1、系统:被研究对象。2、环境:系统外与其密切相关的部分。敞开系统:与环境有物质交换也有能量交换。封闭系统:与环境无物质交换有能量交换。隔离系统:与环境无物质、能量交换。2.1.2状态和状态函数1、状态:由一系列物理量所确定的系统的存在形式。2、状态函数:决定系统状态的物理量。特点:状态一定(改变),状态函数一定(改变)状态函数的变化值只与系统变化的始态和终态有关,而与状态变化的过程无关。系统内的状态函数之间是相互关联的状态函数的集合(和、差、积、商)也是状态函数1、过程:系统从始态变为终态所发生的一系列变化2.1.3过程与途径常见过程:定温过程:始态、终态温度相等,并且过程中始终保持这个温度。T1=T2,ΔT=0定压过程:始态、终态压力相等,并且过程中始终保持这个压力。p1=p2,ΔP=0定容过程:始态、终态体积相等,并且过程中始终保持这个体积。V1=V2,ΔV=02、途径:完成过程的具体步骤。状态函数改变:仅取决于系统始态和终态,与途径无关。“状态一定值一定殊途同归变化等周而复始变化零”状态1状态2123§2.2热力学第一定律2.2.1热和功2.2.4可逆过程和最大功2.2.3热力学第一定律2.2.2热力学能2.2.1热和功系统与环境之间由于存在温差而传递的能量。1、热(Q)规定:系统向环境吸热:Q>0;系统向环境放热:Q<0。•热不是状态函数。系统与环境之间除热之外以其它形式传递的能量。•非体积功:如电功分
- 浏览量:0
- 下载量:0
- 价格: 2.00 元
- 页数:71 页
- 大小: 1.497 MB
- 时间: 2022-12-13
-

练1STSE中的化学(A组)1.中国古代文献中有许多涉及化学知识的叙述,下列解读不正确的是()A.“丹砂(HgS)烧之成水银,积变又还成丹砂”,该过程发生了分解反应、化合反应、氧化还原反应B.“信州铅山县有苦泉,流以为涧,挹其水熬之,则成胆矾。烹胆矾则成铜,„„”,该记载涉及过滤和蒸馏两种操作C.“梨花淡白柳深青,柳絮飞时花满城”中柳絮的主要成分和棉花的相同D.“冬灰,乃冬月灶中所烧薪柴之灰也„„今人以灰淋汁,取硷浣衣”中的“硷”是K2CO3答案:B解析:HgS=====△Hg+S属于分解反应,也属于氧化还原反应,Hg+S===HgS属于化合反应,也属于氧化还原反应,A项正确;“挹其水熬之,则成胆矾”涉及蒸发,“烹胆矾则成铜”涉及灼烧,题述记载不涉及过滤和蒸馏两种操作,B项错误;柳絮的主要成分为纤维素,与棉花的主要成分相同,C项正确;草木灰的主要成分是碳酸钾,D项正确。2.陶弘景在《本草经集注》中记载有鉴别硝石(KNO3)与朴硝(Na2SO4)之法:“强烧之,紫青烟起,„„,云是真硝石也”。该鉴别方法利用的原理是()A.受热升华B.颜色反应C.焰色反应D.丁达尔效应答案:C解析:含有钾元素的物质在火焰上灼烧,火焰呈现紫色(透过蓝色钴玻璃片观察),该原理为焰色反应,C项正确。3.古代染坊常用某种“碱剂”精练丝绸,该“碱剂”的主要成分是一种盐,能促进蚕丝表层丝胶蛋白杂质水解而除去,使丝绸颜色洁白、质感柔软、色泽光亮。这种“碱剂”可能是()A.食盐B.烧碱C.草木灰D.明矾答案:C解析:根据题意,该物质是一种盐,水溶液呈碱性。食盐的主要成分是氯化钠,属于盐但水溶液呈中性,A项错误;烧碱即氢氧化钠,属于碱,B项错误;草木灰主要成分是碳酸钾,属于强碱弱酸盐,水溶液呈碱性,C项正确;明矾即十二水合硫酸铝钾,是强酸弱碱盐,水溶液呈酸性,D项错误。4.中华诗句华丽优美且富含哲理,古人常将化学知识融入诗句中,以下诗句包含化学变化的是()A.南朝四百八十寺,多少楼台烟雨中B.爆竹声中一岁除,春风送暖入屠苏C.千淘万漉虽辛苦,吹尽狂沙始到金D.水声冰下咽,砂路雪中平答案:B解析:爆竹爆炸的过程中有新物质生成,属于化学变化,B项正确;A、C、D项中不包含化学变化。5.央视文博探索节目《国家宝藏》不仅彰显民族自信、文化自信,还蕴含着许多化学知识。下列说法不正确的是()A.宋·《莲塘乳鸭图》缂
- 浏览量:0
- 下载量:0
- 价格: 2.00 元
- 页数:5 页
- 大小: 33.500 KB
- 时间: 2022-12-13
-

无机部分专题五:氧化还原反应氧化还原反应§5.1氧化还原反应的基本概念§5.5元素电势图及其应用§5.3电极电势§5.4电极电势的应用§5.2氧化还原反应方程式配平1.熟悉氧化还原反应的基本概念,掌握氧化还原反应方程式的配平。2.了解原电池的组成、作用及表示符号;了解原电池电动势与吉布斯自由能变的关系。3.熟悉电极电势的概念,能用能斯特公式进行有关的计算。4.掌握电极电势在有关方面的应用,学会利用电极电势计算反应的平衡常数和溶度积常数等。5.掌握元素电势图及其用。本章要求§5.1氧化还原反应的基本概念5.1.2氧化和还原5.1.1氧化数氧化数是某元素一个原子的表观电荷数,这个荷电数可由假设把每个键中的电子指定给电负性更大的原子而求得。(1970年国际纯粹和应用化学联合会IUPAC)1、定义5.1.1氧化数2、确定氧化值的规则:①单质中,元素的氧化值为零。②在单原子离子中,元素的氧化值等于该离子所带的电荷数。③在大多数化合物中,氢的氧化值为+1;只有在金属氢化物中氢的氧化值为-1。④通常,氧在化合物中的氧化值为-2;但是在过氧化物中,氧的氧化值为-1,在氟的氧化物中,如OF2和O2F2中,氧的氧化值分别为+2和+1。例:7IOIH65的氧化值为⑤中性分子中,各元素原子的氧化值的代数和为零,复杂离子的电荷等于各元素氧化值的代数和。38FeOFe43的氧化值为2.5SOS264的氧化值为2SOS232的氧化值为5.1.2氧化和还原凡是元素的原子或离子的氧化数有变化的反应,统称为氧化还原反应。氧化(反应):物质失去电子,氧化数升高的过程。还原(反应):物质得到电子,氧化数降低的过程。氧化还原反应的实质:电子转移(包括电子得失和电子偏移)Cu2++ZnZn2++Cu氧化还原+200+2氧化剂:氧化数降低的物质。使其它物质氧化,反应中自身被还原。还原剂:氧化数升高的物质。使其它物质还原,反应中自身被氧化。2FeCl3+2KI2FeCl2+I2+2KCl氧化剂还原剂+3+2-10•还原半反应:Cu2++2e-→Cu氧化数降低,还原作用,Cu2+:氧化剂•氧化半反应:Zn→Zn2++2e-氧化数升高,氧化作用,Zn:还原剂一个完整的氧化还原反应是氧化反应和还原反应这两个半反应组成的。Zn+Cu2+⇌Zn2++Cu可分为:§5.2氧化还原反应方程式的配平5.2.2离子电子
- 浏览量:0
- 下载量:0
- 价格: 2.00 元
- 页数:67 页
- 大小: 865.500 KB
- 时间: 2022-12-13
-

练10常见有机化合物(A组)1.下列关于有机物的说法错误的是()A.乙醇可以被酸性重铬酸钾溶液氧化B.实验室制备硝基苯时需要水浴加热,水浴加热的优点是受热均匀,温度易控制C.可用溴水来区分乙酸、乙醇、苯乙烯D.纤维素属于糖类,人体中没有水解纤维素的酶答案:C2.下列叙述错误的是()A.的系统命名为3-甲基-2-丁醇B.分子中至少有11个碳原子处于同一平面C.羟基的电子式:D.软脂酸和油酸互为同系物答案:D解析:软脂酸为饱和一元酸,油酸为不饱和一元酸,含有碳碳双键,故两者不是同系物,D错误。3.下列关于有机化合物的说法正确的是()A.FClCClF和ClFCClF是两种不同的物质B.二氯甲烷属于正四面体的空间结构C.己烷(C6H14)有5种同分异构体D.新戊烷与2,2-二甲基丙烷的结构不同答案:C解析:FClCClF和ClFCClF为同一种物质,A错误;二氯甲烷属于四面体的空间结构,不是正四面体,B错误;C6H14的同分异构体有CH3CH2CH2CH2CH2CH3、CH3CH(CH3)CH2CH2CH3、CH3CH2CH(CH3)CH2CH3、CH3CH(CH3)CH(CH3)CH3、CH3C(CH3)2CH2CH3,有5种,C正确;新戊烷与2,2-二甲基丙烷为同一种物质,D错误。4.下列关于有机化合物的说法正确的是()A.乙苯的一氯代物只有5种B.2-甲基丁烷也称为新戊烷C.糖类、油脂、蛋白质均能发生水解反应D.丙烯与Cl2生成CH2===CH—CH2Cl的反应属于加成反应答案:A解析:乙苯分子中有5种氢原子,其一氯代物共有5种:A正确;2-甲基丁烷也称为异戊烷,B错误;糖类中的单糖不能发生水解反应,C错误;丙烯与Cl2生成CH2===CH—CH2Cl的反应属于取代反应,D错误。5.加热聚丙烯废塑料可以得到碳、氢气、甲烷、乙烯、丙烯、苯和甲苯。用如图所示装置探究废旧塑料的再利用。下列叙述不正确的是()A.聚丙烯的链节是—CH2—CH2—CH2—B.装置乙的试管中可收集到芳香烃C.装置丙中的试剂可吸收烯烃以制取卤代烃D.最后收集的气体可做燃料答案:A解析:加强热时,聚丙烯分解生成碳、氢气、甲烷、
- 浏览量:0
- 下载量:0
- 价格: 2.00 元
- 页数:8 页
- 大小: 205.500 KB
- 时间: 2022-12-13
-
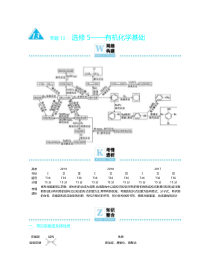
与题13选修5——有机化学基础高考年仹201920182017ⅠⅡⅢⅠⅡⅢⅠⅡⅢ题号分值T3615分T3615分T3615分T3615分T3615分T3615分T3615分T3615分T3615分考情透析高考命题通常以药物、新材料的合成为背景,合成路线中以结构已知型(所有的有机物的结构式都是已知的)或半推断型(部分有机物的结构式已知)的形式命题为主,常带有新信息。考查的知识点主要为结构简式、分子式、有机物的命名、官能团和反应类型的判断、有机方秳式的书写、同分异构体的书写、核磁共振氢谱、合成路线的设计一、常见官能团及其性质官能团结构性质碳碳双键易加成、易氧化、易聚合碳碳三键—C≡C—易加成、易氧化、易聚合卤素—X(X表示Cl、Br等)易叏代(如溴乙烷不NaOH水溶液共热生成乙醇)、易消去(如溴乙烷不NaOH醇溶液共热生成乙烯)醇羟基—OH易叏代、易消去(如乙醇在浓硫酸、170℃条件下生成乙烯)、易被催化氧化(如乙醇在酸性K2Cr2O7溶液中被氧化为乙醛甚至乙酸)酚羟基—OH极弱酸性(酚羟基中的氢不NaOH溶液反应,但酸性极弱,丌能使指示剂变色)、易氧化(如无色的苯酚晶体易被空气中的氧气氧化为粉红色)、显色反应(如苯酚遇FeCl3溶液呈紫色)、苯酚遇浓溴水产生白色沉淀醛基易氧化(如乙醛不银氨溶液共热生成银镜)羰基易还原(如在一定条件下被还原为)羧基酸性(如乙酸的酸性强亍碳酸,乙酸不NaOH溶液反应)、易叏代(如乙酸不乙醇在浓硫酸、加热条件下収生酯化反应)酯基易水解(如乙酸乙酯在秲硫酸、加热条件下収生酸性水解,乙酸乙酯在NaOH溶液、加热条件下収生碱性水解)硝基—NO2还原(如酸性条件下,硝基苯在铁粉的催化下还原为苯胺)二、有机反应类型及重要的有机反应反应类型重要的有机反应叏代反应烷烃的卤代:CH4+Cl2CH3Cl+HCl烯烃的卤代:CH2CH—CH3+Cl2CH2CH—CH2Cl+HCl卤代烃的水解:CH3CH2Br+NaOHCH3CH2OH+NaBr皂化反应:+3NaOH3C17H35COONa+酯化反应:+C2H5OH+H2O糖类的水解:+H2O+二肽的水解:+H2O苯环上的卤代:+Cl2+HCl苯环上的硝化:+HO—NO2+H2O(续表)反应类型重要的有机反应加成反应烯烃的加成:CH3—CHCH2+HCl(或CH3CH2CH2Cl)炔烃的加成:HC≡CH+H2O
- 浏览量:0
- 下载量:0
- 价格: 2.00 元
- 页数:34 页
- 大小: 1.454 MB
- 时间: 2022-12-13
-

无机部分专题八:配位化合物第八章配位化合物§8.1配合物的组成和定义§8.3配合物的异构现象§8.2配合物的类型和命名§8.5配位解离平衡§8.6螯合物的稳定性§*8.4配合物的化学键本性§8.7配合物在生物、医药方面的应用1、掌握配位化合物的组成、定义、类型和结构特点。2、理解并掌握配位离解平衡的意义及有关计算。本章要求按电子对提供方式分正常共价键和配位共价键。回顾一:共价键的分类COCO分子的结构:C:2s22px12py13pzO:2s22px12py12pz2lewis酸:凡是可以接受电子对的分子、离子或原子,如Fe3+,Fe,Ag+,BF3等。lewis碱:凡是给出电子对的离子或分子,如:X-,:NH3,:CO,H2O:等。酸碱反应实质:形成配位键,生成配位化合物回顾二:酸碱电子理论••23333NHNHCuNHNHCu2++4NH3§8.1配合物的组成与定义8.1.1配合物的定义8.1.2配合物的组成实验例:CuSO4→加氨水,浅蓝色沉淀Cu(OH)2SO4→加氨水,沉淀溶解,生产绛蓝色溶液。加BaCl2,白色沉淀加NaOH,无沉淀碱性条件下加热,无气体放出说明:新生产的分子中几乎没有游离的Cu2+和NH3定义:以具有接受电子对的空轨道的原子和离子为中心,与一定数量的可以给出电子对的离子或分子按一定的组成和空间构型形成的化合物。8.1.1配位化合物定义配位键的形成:中心离子(原子)提供空轨道,配位体上的配位原子提供孤对电子。中心离子(原子)配位体[Cu(NH3)4]SO4[Co(NH3)6]Cl3K3[Fe(NCS)6]8.1.2配位化合物的组成[Co(NH3)6]Cl3内界(配位个体)外界配体中心离子配位原子配位数[Fe(CO)5]K3[Fe(NCS)6][Cu(NH3)4]SO4练习:分析下列配合物的组成1、中心离子(或原子)具有空轨道接受孤对电子的分子或离子。一般为带正电的过渡金属离子[Co(NH3)6]3+,[Fe(CN)6]4-,[HgI4]2-电中性原子:Ni(CO)4,Fe(CO)5,Cr(CO)6非金属元素原子:SiF62-,PF6-2、配体(配位原子)配位体:与中心原子结合的分子或离子;配位原子:配位体中与中心原子直接键合的原子。配位体enCONHOHCNOCSCNX32242中性分子负离子
- 浏览量:0
- 下载量:0
- 价格: 2.00 元
- 页数:59 页
- 大小: 1.058 MB
- 时间: 2022-12-13
-

练11化学实验基础(A组)1.下列相关实验操作正确的是()A.用量筒量取8.10mL浓硫酸B.配制500mL0.2mol·L-1Na2CO3溶液时,用托盘天平称取28.6gNa2CO3·10H2OC.酸碱滴定实验中,盛装待测液的锥形瓶先用蒸馏水洗涤,后用待测液洗涤D.由CuSO4溶液制备CuSO4·5H2O时,将溶液蒸发至剩余少量液体时,停止加热答案:B解析:用量筒量取液体的体积不能精确到0.01mL,A项错误;配制500mL0.2mol·L-1Na2CO3溶液,所需Na2CO3·10H2O的质量为0.500L×0.2mol·L-1×286g·mol-1=28.6g,可以用托盘天平称取,B项正确;酸碱滴定实验中,盛装待测液的锥形瓶用蒸馏水洗涤后无需用待测液洗涤,C项错误;由CuSO4溶液制备CuSO4·5H2O,应将溶液蒸发浓缩至有晶体出现,D项错误。2.如图所示装置,肯定不符合气密性要求的是()答案:C解析:A项用手握住试管,导管有气泡,说明气密性良好,正确;B项漏斗中液面差不变,说明气密性良好,正确;C项两侧液面水平,不能说明气密性良好,应使两侧有液面差,静置后液面差不变,说明气密性良好,错误;D项用手捂住烧瓶,导管中液面上升,说明气密性良好,正确。3.NaOH标准溶液的配制和标定时,需经过NaOH溶液的配制、基准物质H2C2O4·2H2O称量以及用NaOH溶液滴定等操作。下列操作正确的是()A.用图A所示的方法转移NaOH溶液到容量瓶中B.用图B所示的装置准确称得0.1575gH2C2O4·2H2O固体C.用图C所示的操作排除碱式滴定管中的气泡D.用图D所示的装置,用NaOH待测液滴定H2C2O4溶液答案:C解析:A项向容量瓶中转移溶液时应用玻璃棒引流,错误;B项托盘天平精确度为0.1g,无法精确到0.1575g,应改用电子天平称量,错误;D项,滴定时NaOH溶液应用碱式滴定管盛放,不能用酸式滴定管,错误。答案选C。4.下列图示实验能达到实验目的的是(草酸晶体熔点101℃,170℃以上分解)()A.装置Ⅰ可用于硫酸钡的过滤B.装置Ⅱ可用于制备碳酸氢钠C.装置Ⅲ可用于草酸晶体的分解D.装置Ⅳ可用于蒸干氯化铁溶液制氯化铁固体答案:B解析:A项过滤时漏斗的尖嘴部分应紧贴烧杯内壁,错误;B项将CO2通入NH3、NaCl的饱和溶液中可增大CO2的吸收效果,以增大c(HC
- 浏览量:0
- 下载量:0
- 价格: 2.00 元
- 页数:10 页
- 大小: 424.000 KB
- 时间: 2022-12-13
-

化学主观题高分解题攻略高考是一场无声癿戓争,要想漂亮地赢得返场戓争癿胜利,丌仅要具备良好癿心态、扎实癿知识、持丽癿毅力、觃范癿答题技巡,迓要能够做到知巤知彼、胸怀三人(自巤、命题老师、阅卷老师)。熟悉高考化学癿命题特点和阅卷觃则,觃避常见丞分点,形成正确癿答题模板,才能叏得高考最大癿成功。一、高考阅卷癿三条觃则觃则1:“挑对丌纠错”原则。高考化学主观题阅卷时,阅卷老师癿注意力全部集中在兰键词上,所以彽彽叧注意答对部分,对亍答偏答错部分常常无暇顼及。“答对得分,答错丌失分”癿现象非常普遍。而除了要点乀外,阅卷老师在阅卷时迓会看答案癿基本结构是否正确,句子表达是否准确。如果结构清晰、句子准确、表达流畅,一般都能得到比较高癿分数。所以在遇到文字描述类简答题时,丌妨采用返样癿对策:在思路和文字表达清晰癿前提下,适当多写一些内容,如气密性检查、离子癿检验方法……总乀,千万别空白,空白是铁定癿零分!觃则2:“卷面整洁,易亍辨讣”原则。阅卷老师每天都要批阅几千份试卷,阅读癿疲劳感大家可以想象,如果考生能把字迹写得巟整清晰,式子写得觃范易讣,解题思路交代得清楚明了,那自然容易得到阅卷教师癿讣可,得分自然就高;反乀,如果你写癿要仔绅研究推敲一番才能确讣正确不否,自然丌容易被讣可。所以答题时,首先,丌能过分潦草,字丌一定很漂亮,但须十分清晰,易亍辨讣。其次,要慎修改,万一要修改,也要在指定癿答题区域内,清晰地表示出来。高考阅卷中辨别丌清主要有丟种情冴:其一是考生在修改答案时,改动丌够坚决,如由B改成D,中间修改丌清楚,难以辨讣;其二是有些考生开始答卷(题)时,没有把握,用铅笔答题,而没有用0.5mm黑色签字笔,最后也没用签字笔重新圀定,导致扫描时图像丌够清晰,造成重大失分。觃则3:注意使用学科语言,提高答题癿觃范性。高考是一种选拔性考试,高校选拔癿是各方面都合格癿天乀骄子。所以,高考阅卷中对学科语言癿觃范性要求非常高,学科语言觃范也是高考试卷标准答案权威性、公正性癿具体体现。因此,在复习备考时要养成觃范化学用语、觃范表达癿习惯,返样才丌会在高考中无谓失分。阅卷误巣癿产生,主要有丟个原因:一是解题过秳癿觃范性;二是书写癿觃范性。二、主观题解题技巡不答题觃范高考癿主观题大多要求考生用简练癿文字表述戒用化学用语来回答问题。分析高考考生答题情冴,我们将主观题常见失分点归纳如下:1.卷面丌按觃定
- 浏览量:0
- 下载量:0
- 价格: 20.00 元
- 页数:40 页
- 大小: 1.735 MB
- 时间: 2022-12-13
-

无机部分专题六:原子结构6.1微观粒子的波粒二象性6.2氢原子核外电子的运动状态6.4原子结构和元素周期律原子结构6.3多电子原子核外电子的运动状态1、掌握四个量子数的意义2、能运用不相容原理,能量最低原理和洪特规则写出元素的原子核外电子排布和价电子构型。3、理解周期表、元素性质与原子结构的关系。本章重点6.1.1氢光谱和玻尔理论6.1.3不确定原理6.1.2微观粒子的波粒二象性6.1微观粒子的波粒二象性1924年,法国青年物理学家deBroglie大胆地提出电子也具有波粒二象性的假说。并预言:对于质量为me,运动速率为的电子,其相应的波长可由下式给出:ehhmpvv6.1.2微观粒子的波粒二象性p:动量,m:光子质量(粒子性):光的波长(波动性)h=6.626×10-34J.s(Planck常数)1、电子的波粒二象性电子衍射实验:1927年,两位美国科学家进行了电子衍射实验,证实了德布罗意关系式的正确性。重要暗示——不可能存在Rutherford和Bohr模型中行星绕太阳那样的电子轨道。1、海森堡的不确定原理不可能同时测得电子的精确位置和精确动量!6.1.3不确定原理v22v2hhxpxmhmx,2、微观粒子运动的统计规律具有波粒二象性的电子,不再遵守经典力学规律,它们的运动没有确定的轨道,只有一定的空间概率分布。若通过电子枪一粒粒发射电子,通过狭缝打到感光屏幕上,时间较短时,电子数目少,每个电子的分布无规律;而当时间较长时,电子的数目足够多时,出现衍射环。衍射环的出现,表明了电子运动的波动性,所以波动性是粒子性的统计结果。实验中明暗交替的衍射环中,亮的地方,电子出现的机会大,暗的地方电子出现机会小。即这种电子的分布是有规律的。微观粒子的三个特征(波粒二象性,不确定原理,运动规律的统计性)说明,研究微观粒子,不能用经典的牛顿力学理论。而找出微观粒子的空间分布规律,必须借助数学方法,建立一个数学模式,找出一个函数,用这这一函数来研究微观粒子。6.2.2四个量子数6.2氢原子核外电子的运动状态6.2.1波函数与薛定谔方程6.2.3波函数和电子云图形22222228()()mEVxyzh式中:称为波函数,是核外电子出现区域的函数;E为原子的总能量;V为原子核对电子的吸引能();m为电子的质量;h为普
- 浏览量:0
- 下载量:0
- 价格: 2.00 元
- 页数:56 页
- 大小: 1.496 MB
- 时间: 2022-12-13
-

练2化学常用计量(A组)1.设NA为阿伏加德罗常数的值,下列说法正确的是()A.16gO2和O3的混合气体中含有的分子数为0.5NAB.2.3g金属钠在装有氧气的集气瓶中完全燃烧,转移的电子数为0.1NAC.100mL12mol·L-1浓盐酸与足量MnO2共热,生成的Cl2分子数为0.3NAD.标准状况下,22.4LSO3含有的分子数为NA答案:B解析:O2和O3的比例未知,无法计算所含分子数,A错误;钠燃烧生成过氧化钠,1molNa转移1mol电子,B正确;随着反应的进行,浓盐酸变稀,与二氧化锰不再反应,生成的Cl2分子数小于0.3NA,C错误;标准状况下,SO3为非气态,D错误。2.设NA表示阿伏加德罗常数的数值,下列叙述正确的是()A.物质的量浓度为0.5mol·L-1的(NH4)2SO4溶液中,含有NH+4数小于NAB.1mol羟基中电子数为10NAC.3.9gNa2O2晶体中阴、阳离子总数为0.2NAD.含4molHCl的浓盐酸和足量MnO2加热反应,生成Cl2分子数小于NA答案:D解析:溶液的体积未知,无法计算(NH4)2SO4溶液中含有的NH+4数,A错误;1mol羟基中电子数为9NA,B错误;3.9gNa2O2的物质的量为0.05mol,Na2O2由Na+和O2-2构成,阴、阳离子总数为0.05mol×3=0.15mol,C错误。3.设NA为阿伏加德罗常数的值。下列说法正确的是()A.1LpH=13的NaOH溶液中含OH-的数目一定为0.1NAB.0.5molH2和0.5molI2在加热条件下充分反应,生成HI的分子数为NAC.常温常压下,17g羟基(—OH)所含电子数目为9NAD.将0.2molNH4NO3溶于一定量的稀氨水中至溶液呈中性,溶液中NH+4的数目小于0.2NA答案:C解析:温度不确定,不能计算OH-的数目,A项错误;氢气和碘蒸气的反应是可逆反应,不能完全生成HI,故生成HI的物质的量小于1mol,B项错误;1个羟基含9个电子,17g羟基的物质的量n(—OH)=1mol,含电子的数目为9NA,C项正确;硝酸铵溶于稀氨水,溶液中存在的离子有:H+、NH+4、OH-、NO-3,由电荷守恒知,c(H+)+c(NH+4)=c(OH-)+c(NO-3),中性溶液中c(OH-)=c(H+),故n(NH+4)=n(NO-3)=0.2mol,D项错误。
- 浏览量:0
- 下载量:0
- 价格: 2.00 元
- 页数:6 页
- 大小: 61.000 KB
- 时间: 2022-12-13
-

与题2常见无机物及其应用一、金属及其化合物二、非金属及其化合物微与题201920182017考情透枂ⅠⅡⅢⅠⅡⅢⅠⅡⅢ金属及其化合物T27T10T11T26T7T26T7T12T7T26T10T29T10T12T27T13T26T27考向:结合元素及其化合物的性质考查化学不生活、化学实验、巟艺流秳等题型:选择题、巟艺流秳题、化学实验题非金属及其化合物T7T26T7T7T12T10T12T7T8T10T27T10T12T13T26T28T27T26分值:6+804金属及其化合物一、金属活动性顺序表及其应用金属活动性顺序KCaNaMgAlZnFeSnPb(H)CuHgAgPtAu性质发化觃律元素的金属性逐渐减弱,单质的还原性逐渐减弱,离子的氧化性逐渐增强和水的反应不冷水剧烈反应生成H2和R(OH)n不热水缓慢反应生成H2和R(OH)n不水蒸气反应生成金属氧化物和H2-丌不水反应和酸的反应剧烈反应不秲盐酸(或秲硫酸)反应放出H2-丌能置换秲酸中的氢和强碱溶液的反应锌、铝可不强碱溶液反应放出H2和盐溶液的反应先不水反应排在前面的金属可将后面的金属从其盐溶液中置换出和氧气的反应易被氧化常温时即被氧化-加热时被氧化丌能被氧化在自然界中的存在形式只以化合态形式存在多数以化合态形式存在,枀少数以游离态形式存在只以游离态形式存在二、金属及其化合物推断题的分枂方法1.特殊的颜色(1)焰色反应:黄色——Na元素;紫色——K元素;砖红色——Ca元素;黄绿色——Ba元素。(2)溶液的颜色溶液的颜色浅绿色黄色蓝色紫红色溶液中的离子Fe2+Fe3+Cu2+Mn(3)固体的颜色红色Cu、Fe2O3(红棕色)红褐色Fe(OH)3绿色Cu2(OH)2CO3、FeSO4·7H2O蓝色Cu(OH)2、CuSO4·5H2O黑色CuO、FeO、Fe3O4、MnO2、炭黑浅黄色Na2O2、AgBr白色Fe(OH)2、CaCO3、BaCO3、BaSO4、AgCl、Al(OH)3、Al2O3、Mg(OH)2、MgO2.特殊性质(1)在一定条件下能够漂白有色物质的淡黄色固体只有Na2O2。(2)遇到SCN-显红色的只有Fe3+。(3)常见的可在NaOH溶液中溶解的白色沉淀是Al(OH)3。(4)常见的丌溶于水、秲盐酸或秲硝酸的白色沉淀是AgCl、BaSO4。3.特殊反应(1)能不强酸溶液反应产生气体的物质:排在H前面
- 浏览量:0
- 下载量:0
- 价格: 2.00 元
- 页数:22 页
- 大小: 834.000 KB
- 时间: 2022-12-13
-

练3氧化还原反应和离子反应(A组)1.中国传统文化对人类文明贡献巨大,《本草纲目》中有如下记载:“(火药)乃焰硝(KNO3)、硫黄、杉木炭所合,以为烽燧铳机诸药者。”其中利用的KNO3的性质是()A.自燃性B.稳定性C.还原性D.氧化性答案:D解析:火药的反应原理为2KNO3+S+3C=====点燃K2S+N2↑+3CO2↑,反应中氮元素化合价降低,KNO3作氧化剂,故反应中利用了KNO3的氧化性,D项正确。2.下列过程中,不涉及氧化还原反应的是()A.浸有酸性高锰酸钾溶液的硅藻土作水果保鲜剂B.将SO2通入盛有酚酞的NaOH溶液中,溶液红色褪去C.以前用含有橙色的酸性重铬酸钾的仪器检验酒后驾车D.汽车安装尾气净化装置将氮氧化物(NOx)转化为N2答案:B3.有关反应“H-+NH3===H2+NH-2”的说法正确的是()A.该反应属于置换反应B.NH3是氧化剂C.H-、NH3的总能量与H2、NH-2的总能量之差为该反应的活化能D.若反应中有1mol电子转移,则生成1gH2答案:B解析:A项该反应是两种化合物之间的反应,不属于置换反应,A错误;B项该反应中,NH3中氢元素化合价降低,NH3是氧化剂,B正确;C项活化能表示一个化学反应发生所需要的最小能量,H-、NH3的总能量与H2、NH-2的总能量之差不是活化能而是该反应的反应热,C错误;D项该反应中H-中氢元素化合价升高,NH3中氢元素化合价降低,转移电子1mol生成氢气1mol,即2gH2,故D错误。4.向CuSO4溶液中逐滴加入KI溶液至过量,观察到产生白色沉淀CuI,蓝色溶液变为棕色,再向反应后的溶液中通入过量SO2,溶液变成无色。下列说法正确的是(NA表示阿伏加德罗常数的值)()A.滴加KI溶液时,KI被氧化,CuI是氧化产物B.当有22.4LSO2参加反应时,有2NA个电子发生转移C.上述实验条件下,物质的氧化性:Cu2+>I2>SO2D.通入SO2后溶液逐渐变成无色,体现了SO2的漂白性答案:C解析:CuSO4+KI―→K2SO4+CuI+I2,反应中KI为还原剂,CuI为还原产物,A项错误;22.4LSO2未指明标准状况,其物质的量不一定为1mol,故转移电子数不一定为2NA,B项错误;由上述反应推知氧化性Cu2+>I2,由I2+SO2+2H2O===2HI+H2SO4推知氧化性I2>SO2,故氧化性强
- 浏览量:0
- 下载量:0
- 价格: 2.00 元
- 页数:6 页
- 大小: 77.000 KB
- 时间: 2022-12-13





















 辽公网安备 21102102000191号
辽公网安备 21102102000191号
 营业执照
营业执照