 DOC
DOC
【文档说明】人教版九年级化学下册第10单元 单元复习十酸和碱 同步测试(含答案).doc,共(5)页,100.000 KB,由MTyang资料小铺上传
转载请保留链接:https://www.ichengzhen.cn/view-57282.html
以下为本文档部分文字说明:
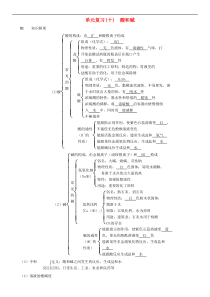
单元复习(十)酸和碱01知识框架(1)酸酸的构成:由H+和酸根离子构成常见的酸盐酸组成(化学式):HCl物理性质:无色液体,有刺激性气味,打开浓盐酸试剂瓶的瓶盖后在瓶口产生白雾,有挥发性用途:重要的化工原料;制造药物;胃液里的盐
酸有助于消化;用于给金属除锈硫酸组成(化学式):H2SO4物理性质:无色,黏稠油状液体,不易挥发,溶于水时放出大量的热,有吸水性浓硫酸的特性:脱水性和很强的腐蚀性浓硫酸的稀释:将浓硫酸沿容器内壁慢慢倒
入水中,同时用玻璃棒不断搅拌酸的通性(H+的性质)能跟指示剂作用,使紫色石蕊溶液变红,不能使无色酚酞溶液变色能跟活泼金属反应,通常生成盐和氢气能跟某些金属氧化物反应,生成盐和水能跟碱反应生成盐和水(2)碱
碱的构成:由金属离子(或铵根离子)和OH-构成常见的碱氢氧化钠(NaOH)俗名:火碱、烧碱、苛性钠物理性质:白色固体;易吸水潮解;易溶于水并放出大量的热特性:很强的腐蚀性用途:重要
的化工原料氢氧化钙[Ca(OH)2]俗名:熟石灰、消石灰物理性质:白色粉末状固体;微溶于水制取:以氧化钙、水为原料用途:建筑业;石灰水用于检测CO2的存在碱的通性(OH-的性质)能跟指示剂作用,使紫色石蕊溶液变
蓝色,使无色酚酞溶液变红色能跟某些非金属氧化物反应,生成盐和水能跟酸反应生成盐和水(3)中和反应定义:酸和碱之间发生的反应,生成盐和水应用:日常生活、工业、农业和医药等(4)溶液的酸碱度表示方法:pHpH的范围(0~14之间)pH<7,
酸性,pH越小,酸性越强pH=7,中性pH>7,碱性,pH越大,碱性越强pH的测定方法最简便方法:使用pH试纸操作:用玻璃棒蘸取待测液滴在pH试纸上,试纸显色后和标准比色卡比较,得出溶液的pH值
注意事项:pH试纸不能先用水湿润;只能测整数了解溶液酸碱度的意义检查人体的健康状况监测雨水pH,了解空气污染情况调节土壤pH,促进农作物生长02单元精练1.下列物质属于碱类的是(A)A.苛性钠B.食
醋C.生石灰D.纯碱2.(2018·广州)下列清洁用品中碱性最强的是(D)A.厕所清洁剂pH=1B.牙膏pH=8C.肥皂pH=10D.炉具清洁剂pH=133.有关实验操作正确的是(B)A.稀释浓硫酸时将水倒入浓硫酸中B.将
氢氧化钠固体放入烧杯中称量C.在量筒中溶解氯化钠固体D.将pH试纸浸入待测液中测定pH4.向含有酚酞的NaOH溶液中滴加盐酸,溶液红色褪去变为无色,此时溶液pH可能是(A)A.5B.9C.12D.135.下列反应属于中和
反应的是(C)A.SO3+2NaOH===Na2SO4+H2OB.CaO+2HCl===CaCl2+H2OC.2NaOH+H2SO4===Na2SO4+2H2OD.Cu(OH)2=====△CuO+H2O6.某同学用pH试纸测定溶液的酸碱度,下列操作或结论正确的是(D)A.先用pH试纸直接蘸取待
测溶液B.先用水润湿pH试纸再测定溶液的酸碱度C.用pH试纸测得石灰水的pH=5D.用pH试纸测得盐酸的pH=17.稀盐酸是化学实验中常用的试剂,但下列实验中,不宜使用稀盐酸的是(C)A.除去氯化钠溶液中的碳酸钠B.除去铜粉中混有
的铁粉C.除去熟石灰中的石灰石D.除去铁丝上的铁锈8.(2018·青岛)根据你所学的化学知识和生活经验判断,下列说法错误的是(B)A.打开浓盐酸试剂瓶瓶塞,能闻到刺激性气味,是因为分子在不断地运动B.滴加洗涤剂能将餐具上的油污洗掉,是因为洗涤剂能溶解油污C.吃松花
蛋时可加入少量食醋,是因为食醋能消除蛋中所含碱性物质的涩味D.稀盐酸能用来除去铁制品表面的铁锈,是因为稀盐酸能与某些金属氧化物反应9.(2017·呼和浩特)某黑色固体粉末可能是Fe、FeO、CuO和C中的一种或几种。取黑色粉末,加入一定量的稀硫酸,待充分反应后过滤,得到滤液和滤
渣,在滤液中插入一根洁净的铁丝。有关说法正确的是(D)A.若滤液呈浅绿色,则原黑色固体粉末中一定有FeB.若铁丝表面只有红色固体析出,则滤渣中一定无CuOC.若铁丝表面无明显现象,则滤渣中最多有四种物质D.若
铁丝表面只有气泡产生,则滤液中溶质一定有H2SO4和FeSO410.(2018·宁波)向盛有20g10%氢氧化钠溶液的烧杯中逐滴滴入7.3%的稀盐酸,下列是关于溶液总质量或溶液pH随盐酸质量变化的关系图(Q点表示恰好完全反应)。其中正确的是(B)11.盐酸、硫酸和氢氧化钠是重要的化工原料
。(1)浓硫酸是实验室常用的气体干燥剂,说明浓硫酸具有____吸水__性。(2)稀盐酸和稀硫酸都可以用于金属除锈,是因为它们的溶液中都含有____H+__。(3)氢氧化钠暴露在空气中,容易潮解,同时吸收空气中的__
__二氧化碳__而变质,所以氢氧化钠固体必须____密封__保存。12.(2017·临沂)用玻璃棒蘸硫酸在白纸上写字,如图。(1)现象:放置一会儿发现用__浓__(填“浓”或“稀”)硫酸在白纸上写的字变黑。(2)结论:同种酸由于__溶
液浓度(或溶质的质量分数)__不同,它们的性质不完全相同。13.将稀盐酸慢慢滴入盛有氢氧化钠溶液的烧杯中,用温度计测量烧杯中溶液的温度,温度随加入稀盐酸的质量变化曲线如图所示:(1)在滴加的过程中,烧杯中溶液的pH逐渐____减小__(填“增大”“减小”或“不变”)。(2)由
图可知,稀盐酸与氢氧化钠溶液发生的反应是____放热__(填“放热”或“吸热”)反应。(3)图中B点时,溶液中的溶质是____NaCl__(填化学式)。14.归纳总结是学习化学的一种方法。请结合小明同学对碱的四点化学性质的归纳图
完成下列问题。(箭头上方的物质是指与碱反应的物质)(1)碱溶液能使无色酚酞溶液变____红色__;(2)氢氧化钠暴露在空气中变质的化学方程式为____2NaOH+CO2===__Na2CO3+H2O__;(3)请帮小明补充完整性质3箭头上方的反应物质是____酸__(填
“酸”“碱”或“盐”);(4)碱溶液有相似的化学性质,是因为碱溶液中都含有____OH-__(填化学符号)。15.某兴趣小组同学将CO2分别通入澄清石灰水和氢氧化钠溶液中,观察到前者变浑浊,后者无明显现象。(1
)写出上述澄清石灰水变浑浊的化学方程式__CO2+Ca(OH)2===CaCO3↓+H2O__。(2)为探究CO2和NaOH是否发生了化学反应,王强设计了如图所示的A、B实验,验证CO2与NaOH溶液发生了化学反应
。实验现象为A中试管内液面上升;B中气球胀大。①王强认为上述实验是可行的,其共同原理是__氢氧化钠溶液与CO2发生反应,使容器内气压降低__。②李莉提出质疑,她认为上述实验不严谨,其理由是__CO2能溶于水,也能使容器内气压降低__。要得到科学严谨的结论,仍利
用该装置,补做的对比实验是__将氢氧化钠溶液换成等体积的水__。③你认为两实验中存在安全隐患的是__A__(填字母序号),理由是__氢氧化钠有腐蚀性,易伤到手__。16.某化学兴趣小组围绕“酸和碱的中和反应”的学习,进行了如下实验:实验一:取5mL氢氧化钠溶液于烧杯中,滴入几滴酚酞溶
液,此时溶液呈__红__色。然后逐滴加入稀盐酸,用玻璃棒搅拌,溶液褪为无色,有关的反应方程式为__HCl+NaOH===NaCl+H2O__,微观实质是__H+与OH-结合生成水__,反应后溶液的温度逐渐升高。实验二:对实验一反应后溶液中的溶质进行探究。【提出猜想】猜想一:只有NaCl
;猜想二:有NaCl和NaOH;猜想三:有NaCl和HCl。你认为猜想__二__不合理,其理由是__若有氢氧化钠,则溶液应该是红色而不是无色__。【设计实验】实验操作实验现象实验结论取反应后的溶液于试管中,加入__锌粒等活泼金属或者碳
酸钙等碳酸盐____有气泡生成__猜想三成立17.(2018·黄石)取15.0g赤铁矿样品(杂质不溶于水,且不与酸反应)于烧杯中,逐渐加入稀盐酸充分反应。所加盐酸的质量与烧杯中剩余固体的质量的关系如下图所示。求:(1)该样品中氧化铁的质量为__9.6__g;(2)稀盐酸中溶质的质量分数为多
少?(精确到0.01%,请写出计算过程)解:设恰好完全反应时,所用稀盐酸中氯化氢的质量为x。Fe2O3+6HCl===2FeCl3+3H2O1602199.6gx160219=9.6gxx=13.14g稀盐酸中溶质的质量分数是13.14g200g×100%=6.57
%答:稀盐酸中溶质的质量分数是6.57%。
 辽公网安备 21102102000191号
辽公网安备 21102102000191号
 营业执照
营业执照