 DOC
DOC
【文档说明】高中化学必修第一册《第一节 铁及其化合物》教学设计1-统编人教版.docx,共(19)页,931.072 KB,由小喜鸽上传
转载请保留链接:https://www.ichengzhen.cn/view-111451.html
以下为本文档部分文字说明:
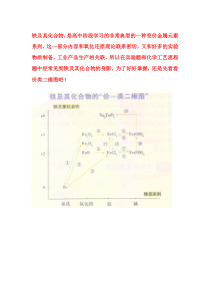
铁及其化合物,是高中阶段学习的非常典型的一种变价金属元素系列,这一部分内容和氧化还原理论联系密切,又和好多的实验物质制备,工业产品生产相关联,所以在实验题和化学工艺流程题中经常见到铁及其化合物的身影,为了好好掌握,还是先看看价类二维图吧!
1、铁的误区警示常温下,铁与水不反应,只有在高温条件下,Fe才会与水蒸气反应。1.某研究小组为了探究“铁与水蒸气”能否发生反应及反应的产物,进行了下列实验:用如图所示实验装置,在硬质玻璃管B中放入还原铁粉和石棉绒的混合物,再结合一些步骤,就可以完成高温下“Fe与水蒸气的反应实验”
(已知石棉绒是耐高温材料,不与水和铁反应)。Ⅰ.探究“铁与水蒸气”能否发生反应(1)如何检查该装置的气密性。(2)实验中石棉绒的作用是。(3)反应一段时间后,有肥皂泡吹起时,用点燃的火柴靠近肥皂泡,当时(填实验现象),说明“铁与水蒸气”能够进行反应,写出铁与水蒸气反应的化学方程式。Ⅱ.探
究“铁与水蒸气”反应的产物(1)假设还原铁粉反应完全,黑色固体为某种单一成分,为研究黑色固体成分,该研究小组甲同学提出以下假设:假设一:黑色固体全部是Fe3O4假设二:黑色固体全部是Fe2O3假设三:黑色固体全部是FeO乙同学认为即使不通过
实验就可以否定甲同学的一个假设,你认为乙同学否认的假设是,理由是。(2)若假设一正确,请设计实验加以验证,完成下列表格(仪器自选)。限选实验试剂:1mol·L-1硫酸、2mol·L-1NaOH溶液、新制氯水、澄清石灰水、酸性KMnO4溶液、KSCN溶液、品红溶液实验步骤
预期实验现象与结论取反应后干燥的固体于试管中,加入足量的1mol·L-1硫酸溶解【答案加评分标准】Ⅰ.(1)将C处导气管末端浸入水槽中,微热A处圆底烧瓶,气管末端出现气泡,停止加热后气管末端出现一段水柱,则气密性
好,否则气密性不好(2分)(2)增大铁粉与水蒸气的接触面积(1分)(3)肥皂泡破裂,有爆鸣声(2分)3Fe+4H2O(g)Fe3O4+4H2(2分)Ⅱ.(1)假设二(1分)由于Fe2O3为红棕色粉末,则可以根据固体颜色直接否定假设二(1分)实验步骤预期
实验现象与结论取反应后干燥的固体于试管中,加入足量的1mol·L-1硫酸硫酸溶解①取少量上述溶液于一试管中,滴加1~2滴KSCN溶液(1分)②另取少量上述溶液于另一试管中,滴加2~3滴酸性KMnO4溶液(1分)①溶液变红色,则反应后的固体中含有+3价的铁(1分)②溶液不显紫色,则反
应后的固体中含有+2价的铁,综合上述步骤①②可知假设一正确。(2分)【解析】△试题分析:Ⅰ.(1)气密性检查一般用液差法,即将C处导气管末端浸入水槽中,微热A处圆底烧瓶,气管末端出现气泡,停止加热后气管末端出现一段水柱,则气密性好,否则气密性
不好。(2)石棉绒的接触面积大,可增大铁粉与水蒸气的接触面积,加快反应速率。(3)反应一段时间后,有肥皂泡吹起时,反应中有氢气产生,因此用点燃的火柴靠近肥皂泡,当肥皂泡破裂,有爆鸣声时(填实验现象),说
明“铁与水蒸气”能够进行反应,铁与水蒸气反应的化学方程式为3Fe+4H2O(g)Fe3O4+4H2。Ⅱ.(1)由于Fe2O3为红棕色粉末,则可以根据固体颜色是黄色直接否定假设二。(2)四氧化三铁中铁元素的价态有+2价和+3价,可以根据亚铁离子和铁离子检验验证假设一正确,即实验步骤预期实验现象与结
论取反应后干燥的固体于试管中,加入足量的1mol·L-1硫酸硫酸溶解①取少量上述溶液于一试管中,滴加1~2滴KSCN溶液(1分)②另取少量上述溶液于另一试管中,滴加2~3滴酸性KMnO4溶液(1分)①溶液变红色,则反应后的固体中含有+3价的铁(1分)②溶液不显紫色,则反
应后的固体中含有+2价的铁,综合上述步骤①②可知假设一正确。(2分)考点:考查铁与水蒸气反应实验设计与探究△2.铁的还原性铁是变价金属,与强氧化剂反应生成三价铁,与弱氧化剂反应生成二价铁。(1)铁与弱氧化剂如:H+、Cu2+、S、I2反应时,被氧化为+2价。(2)铁与H2O(g
)、O2反应的氧化产物为Fe3O4。(3)铁与Cl2、Br2等反应时,被氧化为+3价。2.下列反应中,铁只能生成高价化合物的是A.过量的铁与稀HNO3反应B.铁粉与硫蒸气反应C.铁粉与氯气反应D.红热的铁粉与水蒸气反
应【答案】C【解析】【分析】铁遇到强的氧化剂反应生成三价铁离子,遇到弱的氧化剂反应生成二价铁离子,据此解答.【详解】A.过量的铁与稀HNO3反应硝酸亚铁,故A不选;B.铁粉与硫蒸气反应生成硫化亚铁,故B不选;C.氯气具
有强的氧化性,能够与铁反应生成氯化铁,故C选;D.红热的铁粉与水蒸气反应生成四氧化三铁和氢气,故D不选;故选:C。3.铁的氧化物(1)铁的氧化物中Fe的常见化合价只有+2价和+3价,Fe3O4可以看成由FeO和Fe2O3按物质的量之比1∶1组合而成的复杂氧化物,通常也可写成FeO·Fe2O3的形式
。(2)FeO、Fe2O3属于碱性氧化物,Fe3O4不属于碱性氧化物。(3)Fe3O4与盐酸反应可看作Fe2O3、FeO分别与盐酸反应,然后把两个反应式相加。(4)FeO、Fe3O4遇氧化性酸(如HNO3)发生氧化还原反应
,+2价的铁均被氧化成+3价。3.下列关于铁的氧化物说法不正确的是()A.铁的氧化物通常状况下都是有色固体B.四氧化三铁是一种复杂的铁的氧化物,它与盐酸反应后的溶液中同时存在Fe2+和Fe3+C.氧化铁是铁锈的主要成分,因此氧化铁俗称为铁锈D.工业上常使用铁的
氧化物做原料冶炼铁【答案】C【解析】A、铁的氧化物通常状况下都是有色固体,如氧化铁是红棕色,氧化亚铁和四氧化三铁都是黑色的,故A正确;B、四氧化三铁是一种复杂的铁的氧化物,其中1/3是Fe2+、2/3是Fe3+,Fe3O4可看作是由FeO、Fe2O3形成的化合物。[实质是F
e(FeO2)2,偏铁酸亚铁盐],,它与盐酸反应后的溶液中同时存在Fe2+和Fe3+,B正确;C、铁锈的主要成分是Fe2O3·XH2O,故C错误;D、工业上常使用铁的氧化物做原料用一氧化碳冶炼铁,故D正确;故选C。4.Fe(OH)2制备时的注意事项(1)Fe2+易被氧化
,所以FeSO4溶液要现用现配,且配制FeSO4溶液的蒸馏水要煮沸除去氧气。(2)为了防止NaOH溶液加入时带入空气,可将吸有NaOH溶液的长滴管伸入到FeSO4溶液的液面下,再挤出NaOH溶液。(3)为防止Fe
2+氧化,还可向盛有FeSO4溶液的试管中加入少量煤油液封。4.某实验小组在实验室利用氨气和新制备的硫酸亚铁溶液反应制备氢氧化亚铁。(一)制备硫酸亚铁溶液(1)步骤①,加入稀硫酸的目的是_______。(2)步骤②,加入还原铁粉后观察到的现象是_______。(二)制备氢氧化亚铁(3)选择上图中
的装置制备氢氧化亚铁,连接顺序为_______(按气流方向,用装置字母表示)。反应结束后继续通一段时间的N2,目的是_______。(4)装置B中发生反应的离子方程式是_______。装置C的作用是_______。(三)探究思考
反应后将装置B中固体过滤时白色沉淀会逐渐转变为灰绿色。在查阅不同资料后,有同学认为灰绿色物质是Fe(OH)2被空气中的氧气氧化后生成的Fe3(OH)8。(5)Fe3(OH)8中n(Fe2+):n(Fe3+)=_______,用氧化物的形式表示可写成_______。(6)设计实验证明灰绿色
物质中含Fe3(OH)8:_______。【答案】抑制Fe2+的水解铁粉逐渐溶解,有无色气体生成,溶液由黄色逐渐变为浅绿色ACBD防止拆除装置时残留的氨气逸出污染空气Fe2++2NH3+2H2O=Fe(OH)2+2NH4+安全瓶,防倒吸1:2FeO·Fe2O3·4H2O取
少量灰绿色物质于试管中,加入稀盐酸(或稀硫酸)溶解,将溶液分成两份,一份滴入几滴KSCN溶液,变为血红色;另一份加入适量K3[Fe(CN)6]溶液,生成蓝色沉淀,则灰绿色物质中含Fe3(OH)8【解析】该实验的目的是利用氨气和新制备的硫酸亚铁
溶液反应制备氢氧化亚铁。(一)制备硫酸亚铁溶液,向硫酸铁晶体中加入去氧蒸馏水和稀硫酸,再加入过量的还原铁粉,将Fe3+还原成Fe2+,得到硫酸亚铁溶液。(1)步骤①,加入稀硫酸的目的是,目的是抑制Fe3+的水解;(2)步骤②,加入还
原铁粉后,铁粉和酸反应和Fe3+反应,观察到的现象是铁粉逐渐溶解,有无色气体生成,溶液由黄色逐渐变为浅绿色;(二)制备氢氧化亚铁,原理是将氨气通入硫酸亚铁溶液中,此过程的关键是隔绝空气。(3)制备氢氧化亚铁的装置中,A装置的作用是将浓氨水滴到生石灰上
,使生石灰和水反应放出热量,放出氨气,氮气的作用是将装置中的空气全部排出,B装置的作用是氨气和硫酸亚铁溶液反应产生氢氧化亚铁,C装置的作用是作为安全瓶防止倒吸,D装置的作用是吸收尾气。故装置连接顺序为ACBD;反应结束后继续通一段时间的N2,目的是将装置中残留的氨
气全部被吸收,防止拆除装置时残留的氨气逸出污染空气;(4)装置B中发生反应的离子方程式是:Fe2++2NH3+2H2O=Fe(OH)2+2NH4+,装置C在A和B之间,故C的作用是:安全瓶,防倒吸;(5)Fe3(OH)8中,3个Fe带8个正电荷,故n(Fe2+):
n(Fe3+)=1:2,用氧化物的形式表示可写成FeO·Fe2O3·4H2O;(6)要设计实验证明灰绿色物质中含Fe3(OH)8,即要证明此物质中既有Fe2+又有Fe3+,Fe2+用K3[Fe(CN)6]溶液检验,Fe3+用KSCN溶液
检验,故试验方法为:取少量灰绿色物质于试管中,加入稀盐酸(或稀硫酸)溶解,将溶液分成两份,一份滴入几滴KSCN溶液,变为血红色;另一份加入适量K3[Fe(CN)6]溶液,生成蓝色沉淀,则灰绿色物质中含Fe3(OH)8。点
睛:实验题的关键是搞清楚实验目的:利用氨气和新制备的硫酸亚铁溶液反应制备氢氧化亚铁。结合题意,先制备硫酸亚铁溶液,向硫酸铁晶体中加入去氧蒸馏水和稀硫酸,再加入过量的还原铁粉,将Fe3+还原成Fe2+,得到硫酸亚铁溶
液,再制备氢氧化亚铁,原理是将氨气通入硫酸亚铁溶液中,此过程的关键是隔绝空气。就可知各装置的目的,各个措施的目的,就可以顺利的解题。5.检验Fe2+的注意事项(1)只含Fe2+的溶液检验Fe2+加入试剂的顺序:待测液――→KSCN溶液不变色――→氧化剂如氯水、H2O2红色(含F
e2+,不含Fe3+)。①加KSCN溶液前,不能加氧化性物质[如H2O2、NO-3(H+)等],防止Fe2+被氧化。②氧化剂不能选用酸性KMnO4溶液,原因有:酸性KMnO4溶液本身显紫红色,对Fe(SCN)3红色
有干扰;酸性KMnO4溶液能氧化KSCN,溶液不变红色,不能证明不含Fe2+。(2)同时含有Fe2+和Fe3+的溶液Fe2+对检验Fe3+无干扰,可以滴加KSCN溶液检验Fe3+;Fe3+对检验Fe2+有干扰,不能加KSCN溶液检验Fe2+,通常向溶液中滴加适量酸性KMnO4溶液,溶液紫红色褪
去说明含有Fe2+(当然如果含有氯离子这个方法就不行了)。5.为了检验某氯化亚铁溶液是否变质,可向溶液中加入()A.氢氧化钠溶液B.铁片C.硫氰酸钾溶液D.酸性KMnO4溶液【答案】C【解析】FeCl2与NaOH溶液反应先生成Fe(OH)2,后被O2氧化为Fe(OH)3,会干扰Fe3+的检验,
故A项不符合;Fe与Fe3+反应时,溶液颜色变化不明显,故B项不符合;Fe2+与SCN-不反应,但Fe3+与SCN-反应使溶液变红色,故C项符合;KMnO4只与Fe2+反应,不与Fe3+反应,故D项不符合。6.
Fe2+、Fe3+、Fe之间的相互转化关系(1)Fe只具有还原性。可被弱氧化剂(H+、S等)氧化成Fe2+,被强氧化剂(Cl2等)氧化成Fe3+。(2)Fe2+既有氧化性又有还原性。可被强氧化剂[Cl2、KMnO4(H+)等]氧化为Fe3+;可被还原剂(Al、Zn、CO
、C等)还原为Fe。(3)Fe3+只具有氧化性,可被弱还原剂(Fe、Cu等)还原为Fe2+,被强还原剂(Al、Zn、CO等)还原为Fe。6.阅读下列材料后,回答相应问题。一个体重50Kg的健康人,含铁2g。这2g铁在人体中
不是以单质金属的形式存在的,而是以Fe2+和Fe3+的形式存在。二价铁离子易被吸收,给贫血者补充铁时,应给予含二价铁离子的二价铁盐,如硫酸亚铁(FeSO4)。服用维生素C,可使食物中的三价铁离子还原成二价铁离子,有利与铁的吸收。(1)人体中经
常进行Fe2+Fe3+的转化,A中Fe2+作______剂,B中Fe3+作________剂。(2)“服用维生素C,可使食物中的三价铁离子还原成二价铁离子。”这句话指出维生素C在这一反应中作__________
剂,具有___________性。【答案】还原氧化还原还原【解析】(1)所含元素化合价升高的物质为还原剂,含元素化合价降低的物质为氧化剂;(2)根据铁元素的化合价变化可知+3价Fe3+被还原来分析维生
素C的作用,并利用还原剂具有还原性来解答。【详解】(1)在A中铁元素的化合价由+2价升高到+3价,铁元素的化合价升高,则A中Fe2+作还原剂,在B中铁元素的化合价由+3价降低为+2价,铁元素的化合价降低,则B中Fe3+作氧化剂;(2)由信息维生素C可使食物中的+3价Fe3+还原成+2价F
e2+,该反应中铁元素的化合价降低,则维生素C中某元素的化合价升高,即维生素C为还原剂,体现还原性。【点睛】本题属于信息习题,考查氧化还原反应中氧化剂、还原剂的概念及其与氧化性、还原性的关系,明确元素的化合价变化来分析是解答本题的关键。7.铁及其化合物的颜色铁粉是黑色的;铁块是银
白色的Fe2+—浅绿色Fe3O4—黑色晶体Fe(OH)2—白色沉淀Fe3+—黄色Fe(OH)3—红褐色沉淀Fe(SCN)3—血红色溶液FeO—黑色粉末Fe2O3—红棕色粉末FeS—黑色固体这部分内容有时候作为基础题考察记忆颜色的准确性,更多的时候是作为一些推断题的突破口。所以就不再找习题了
,仔细在以后的题目中体会就行了。8.铁的归纳(1)金属阳离子被还原不一定得到金属单质如:Fe3+―→Fe2+。(2)离子共存问题①Fe3+与I-、S2-、HS-、SO2-3、HSO-3等因发生氧化还原反应而不能
大量共存。②Fe2+与MnO-4(H+)、NO-3(H+)、ClO-等因发生氧化还原反应而不能大量共存。(3)除杂问题(括号内为杂质)①FeCl3溶液(FeCl2):加足量氯水或H2O2或通入足量Cl2。②FeCl2溶液(FeCl3):加足量铁粉,充分反应后
过滤。③FeSO4溶液(CuSO4):加足量铁粉,充分反应后过滤。8.氯化亚铁具有独有的脱色能力,适用于染料、染料中间体、印染、造纸行业的污水处理。某课题小组设计如下方案制备氯化亚铁并探究氯化亚铁(Fe2+)的还原性。方案Ⅰ:甲同学设计如下装
置制备氯化亚铁。已知:实验室常用氯化钠固体与浓硫酸共热制备氯化氢;氯化亚铁能与水蒸气剧烈反应。(1)写出A中反应的化学方程式:_______________。B中盛装的试剂为____________________,D装置中四氯化碳的作用是__
___________。(2)实验过程中,观察到D中现象是___________________________________________。用物理方法检验氯化亚铁产品中是否混有铁粉:______________。(3)上述方案有明显不足,请你提出改进上述方案的建议:__________
____________。方案Ⅱ:乙同学选择下列装置用氯化铁制备少量氯化亚铁(装置可以重复使用,氯化铁遇水剧烈水解)。查阅资料知,在加热条件下,氢气还原氯化铁生成氯化亚铁和氯化氢。(4)气流从左至右,装置接口连接顺序是a
______________________________________。(5)设计简单实验证明氢气和氯化铁已发生反应:__________________________________。(6)为了探究上述实验制备
的氯化亚铁(Fe2+)具有还原性,设计如下方案:a.取少量氯化亚铁样品溶于蒸馏水,滴加酸性高锰酸钾溶液,观察现象b.取少量氯化亚铁样品溶于蒸馏水,滴加酸化的双氧水和KSCN溶液,观察现象c.取少量氯化亚铁样品溶于蒸馏水,
滴加铁氰化钾溶液,观察现象d.取少量氯化亚铁样品溶于蒸馏水,先加KSCN溶液,后加氯水,观察现象上述方案合理的是________(填代号)。【答案】2NaCl+H2SO4(浓)=Na2SO4+2HCl↑浓硫酸防倒吸有气泡逸出用磁铁吸附,若有
黑色粉末被吸起,则混有铁粉;否则,没有混入铁粉在C、D之间增加一个盛有浓硫酸的试剂瓶(或将D换成盛装碱石灰的干燥管)cb→gh→cb→d在G中滴加硝酸银溶液,若产生白色沉淀,则已发生反应;否则,未发生反应d【解析】(1)氯化钠固体与浓硫酸共热生成硫酸钠和氯化氢;装置B中加入
的试剂是浓硫酸;四氯化碳与氯化氢不反应,四氯化碳起防倒吸作用;(2)磁铁可以吸附铁粉,若有黑色粉末被吸起,则混有铁粉;否则,没有混入铁粉;(3)在C、D之间增加一个盛有浓硫酸的试剂瓶(或将D换成盛装碱石灰的干燥管);(4)该装置包括制取氯
化氢、干燥、氯化氢与铁反应、干燥(防止水蒸气与铁反应)、尾气吸收(防倒吸),气流从左至右,装置接口连接顺序是a→cb→gh→cb→d;(5)H2+2FeCl3=2FeCl2+2HCl,检验氯化氢可以确认氢气与氯化铁是否已发生反应;(6)根据
验证氯化亚铁中(Fe2+)具有还原性,要排除Cl-、Fe3+的干扰进行判断。【详解】(1)氯化钠固体与浓硫酸共热生成硫酸钠和氯化氢,反应方程式为:2NaCl+H2SO4(浓)=Na2SO4+2HCl↑,装置B中加入的试剂是浓硫酸,四氯化碳与氯化氢不反应,四氯化碳起防倒吸
作用,故答案为:2NaCl+H2SO4(浓)=Na2SO4+2HCl↑,浓硫酸,防倒吸。(2)氯化氢与铁粉反应生成氯化亚铁和氢气,在D中逸出了氢气,用磁铁可以吸附铁粉,若有黑色粉末被吸起,则混有铁粉;否则,没有混入铁粉,故答案为:有气泡逸出
;用磁铁吸附,若有黑色粉末被吸起,则混有铁粉;否则,没有混入铁粉。(3)该装置包括制取氯化氢、干燥、氯化氢与铁反应、干燥(防止水蒸气与铁反应)、尾气吸收(防倒吸),所以在C、D之间增加一个盛有浓硫酸的试剂瓶(或将D
换成盛装碱石灰的干燥管),故答案为:在C、D之间增加一个盛有浓硫酸的试剂瓶(或将D换成盛装碱石灰的干燥管)。(4)该装置包括制取氯化氢、干燥、氯化氢与铁反应、干燥(防止水蒸气与铁反应)、尾气吸收(防倒吸),气流
从左至右,装置接口连接顺序是a→cb→gh→cb→d,故答案为:cb→gh→cb→d。(5)H2+2FeCl3=2FeCl2+2HCl,检验氯化氢可以确认氢气与氯化铁是否已发生反应,方法为:在G中滴加硝酸银溶液,若产生白色沉淀,则已发生反应;否则,未发生反应,故答案为:在G中滴加硝酸银溶
液,若产生白色沉淀,则已发生反应;否则,未发生反应。(6)验证氯化亚铁中(Fe2+)具有还原性,要排除Cl-、Fe3+的干扰。a.氯离子能和酸性高锰酸钾溶液反应,也能使溶液褪色,故a错误;b.加入酸化的双氧水和KSCN溶液,可能
有Fe3+的干扰,所以溶液显红色不一定是Fe2+被氧化为Fe3+,故b错误;c.加入铁氰化钾溶液,只能检验Fe2+,不能证明Fe2+具有还原性,故C错误;d.滴加KSCN溶液,无颜色变化,再滴加氯水,溶液变红色,说明Fe2+具有还原性,故d正确。故答案为:d。
 辽公网安备 21102102000191号
辽公网安备 21102102000191号
 营业执照
营业执照